Kacheksja to choroba układowa charakteryzująca się utratą masy ciała, zanikiem mięśni i tkanki tłuszczowej oraz stanem zapalnym. Kacheksja jest jednym z głównych powikłań i przyczyn zgonów u pacjentów onkologicznych. Oprócz nowotworów, wyniszczenie może być spowodowane różnymi przewlekłymi chorobami nienowotworowymi, w tym niewydolnością serca, niewydolnością nerek, przewlekłą obturacyjną chorobą płuc, chorobami neurologicznymi, AIDS i reumatoidalnym zapaleniem stawów. Szacuje się, że częstość występowania wyniszczenia u pacjentów onkologicznych może sięgać 25–70%, co poważnie wpływa na jakość życia pacjentów i nasila toksyczność leczenia.
Skuteczna interwencja w kacheksji ma ogromne znaczenie dla poprawy jakości życia i rokowania pacjentów onkologicznych. Jednak pomimo pewnego postępu w badaniach nad patofizjologicznymi mechanizmami kacheksji, wiele leków opracowanych w oparciu o możliwe mechanizmy jest jedynie częściowo skutecznych lub nieskutecznych. Obecnie nie ma skutecznego leczenia zatwierdzonego przez Amerykańską Agencję ds. Żywności i Leków (FDA).
Istnieje wiele przyczyn niepowodzeń badań klinicznych nad wyniszczeniem organizmu, a podstawową przyczyną może być brak dogłębnego zrozumienia mechanizmu i naturalnego przebiegu wyniszczenia organizmu. Niedawno profesor Xiao Ruiping i badacz Hu Xinli z College of Future Technology Uniwersytetu Pekińskiego opublikowali wspólnie artykuł w czasopiśmie „Nature Metabolism”, ujawniając istotną rolę szlaku mlekowego-GPR81 w występowaniu wyniszczenia nowotworowego, co stanowi nową koncepcję leczenia wyniszczenia organizmu. Podsumowujemy to, syntetyzując artykuły z czasopism „Nat Metab”, „Science”, „Nat Rev Clin Oncol” i innych.
Utrata masy ciała jest zazwyczaj spowodowana zmniejszonym spożyciem pokarmu i/lub zwiększonym wydatkiem energetycznym. Wcześniejsze badania sugerowały, że te fizjologiczne zmiany w wyniszczeniu związanym z guzem są napędzane przez pewne cytokiny wydzielane przez mikrośrodowisko guza. Na przykład czynniki takie jak czynnik różnicowania wzrostu 15 (GDF15), lipokalina-2 i białko insulinopodobne 3 (INSL3) mogą hamować przyjmowanie pokarmu poprzez wiązanie się z miejscami regulującymi apetyt w ośrodkowym układzie nerwowym, co prowadzi do anoreksji u pacjentów. IL-6, PTHrP, aktywina A i inne czynniki powodują utratę masy ciała i zanik tkanek poprzez aktywację szlaku katabolicznego i zwiększenie wydatku energetycznego. Obecnie badania nad mechanizmem wyniszczenia koncentrują się głównie na tych wydzielanych białkach, a niewiele badań dotyczyło związku między metabolitami guza a wyniszczeniem. Profesor Xiao Ruiping i badacz Hu Xinli zastosowali nowe podejście, aby ujawnić ważny mechanizm wyniszczenia związanego z guzem z perspektywy metabolitów guza.
Najpierw zespół profesora Xiao Ruipinga przebadał tysiące metabolitów we krwi zdrowych osobników z grupy kontrolnej oraz myszy z wyniszczeniem nowotworowym płuc i stwierdził, że kwas mlekowy był metabolitem o najwyższym podwyższonym poziomie u myszy z wyniszczeniem nowotworowym. Stężenie kwasu mlekowego w surowicy rosło wraz ze wzrostem guza i wykazywało silną korelację ze zmianą masy ciała myszy z guzem. Próbki surowicy pobrane od pacjentów z rakiem płuc potwierdzają, że kwas mlekowy odgrywa również kluczową rolę w progresji wyniszczenia nowotworowego u ludzi.
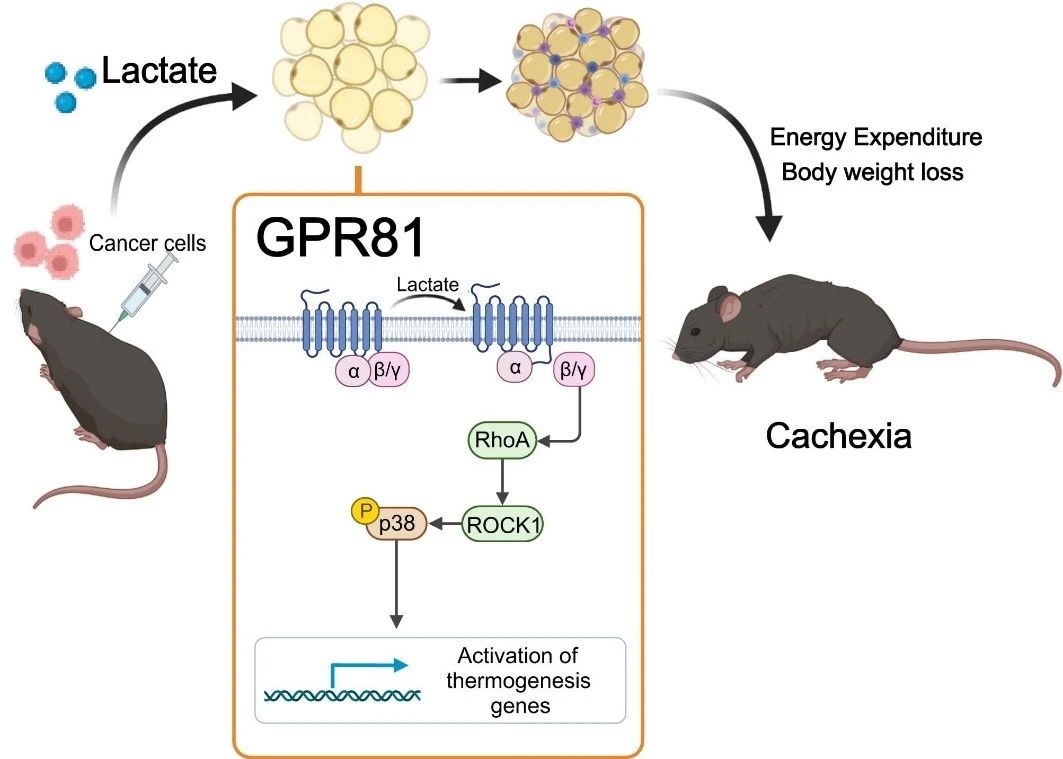
Aby ustalić, czy wysoki poziom kwasu mlekowego powoduje wyniszczenie, zespół badawczy wprowadził kwas mlekowy do krwi zdrowych myszy za pomocą pompy osmotycznej wszczepionej pod skórę, sztucznie podnosząc poziom kwasu mlekowego w surowicy do poziomu występującego u myszy z wyniszczeniem. Po 2 tygodniach u myszy rozwinął się typowy fenotyp wyniszczenia, taki jak utrata masy ciała, zanik tkanki tłuszczowej i mięśniowej. Wyniki te sugerują, że przebudowa tkanki tłuszczowej indukowana mleczanem jest podobna do tej indukowanej przez komórki nowotworowe. Mleczan jest nie tylko charakterystycznym metabolitem wyniszczenia nowotworowego, ale także kluczowym mediatorem hiperkatabolicznego fenotypu indukowanego przez nowotwór.
Następnie odkryli, że usunięcie receptora mleczanowego GPR81 skutecznie łagodziło objawy wyniszczenia nowotworowego i kacheksji wywołanej przez mleczan w surowicy, nie wpływając na poziom mleczanu w surowicy. Ponieważ GPR81 jest silnie ekspresjonowany w tkance tłuszczowej, a zmiany w tkance tłuszczowej zachodzą wcześniej niż w mięśniach szkieletowych w trakcie rozwoju wyniszczenia, swoisty efekt wybicia genu GPR81 w tkance tłuszczowej myszy jest podobny do efektu systemowego wybicia genu, poprawiając utratę masy ciała wywołaną przez guz oraz zużycie tłuszczu i mięśni szkieletowych. Sugeruje to, że GPR81 w tkance tłuszczowej jest niezbędny do rozwoju wyniszczenia nowotworowego wywołanego kwasem mlekowym.
Dalsze badania potwierdziły, że po związaniu się z GPR81 cząsteczki kwasu mlekowego powodują brunatnienie tłuszczowe, lipolizę i zwiększoną produkcję ciepła w organizmie poprzez szlak sygnałowy Gβγ-RhoA/ROCK1-p38, a nie klasyczną ścieżkę PKA.
Pomimo obiecujących wyników w patogenezie wyniszczenia nowotworowego, odkrycia te nie przełożyły się jeszcze na skuteczne metody leczenia, dlatego obecnie nie ma standardów leczenia tych pacjentów. Niektóre towarzystwa, takie jak ESMO i Europejskie Towarzystwo Żywienia Klinicznego i Metabolizmu (ESMO), opracowały jednak wytyczne kliniczne. Obecnie międzynarodowe wytyczne zdecydowanie zalecają promowanie metabolizmu i ograniczanie katabolizmu poprzez takie działania, jak żywienie, aktywność fizyczna i farmakoterapia.
Czas publikacji: 28-04-2024