U około 1,2% osób w ciągu życia zostanie zdiagnozowany rak tarczycy. W ciągu ostatnich 40 lat, dzięki powszechnemu stosowaniu badań obrazowych i wprowadzeniu biopsji cienkoigłowej, wskaźnik wykrywalności raka tarczycy znacznie wzrósł, a zapadalność na raka tarczycy wzrosła trzykrotnie. Leczenie raka tarczycy poczyniło duże postępy w ciągu ostatnich 5–10 lat, a wiele nowych protokołów uzyskało aprobatę organów regulacyjnych.
Narażenie na promieniowanie jonizujące w dzieciństwie było najsilniej związane z rakiem brodawkowatym tarczycy (1,3 do 35,1 przypadków/10 000 osobolat). Badanie kohortowe, w którym przebadano 13 127 dzieci poniżej 18. roku życia mieszkających na Ukrainie po katastrofie jądrowej w Czarnobylu w 1986 roku pod kątem raka tarczycy, wykazało łącznie 45 przypadków raka tarczycy, przy czym ryzyko względne raka tarczycy było wyższe o 5,25/Gy. Istnieje również zależność dawka-odpowiedź między promieniowaniem jonizującym a rakiem tarczycy. Im młodszy wiek, w którym nastąpiło narażenie na promieniowanie jonizujące, tym wyższe ryzyko rozwoju raka tarczycy związanego z promieniowaniem, które utrzymywało się prawie 30 lat po narażeniu.
Większość czynników ryzyka raka tarczycy jest niezmienna: wiek, płeć, rasa lub pochodzenie etniczne oraz historia rodzinna raka tarczycy są najważniejszymi czynnikami predykcyjnymi. Im starszy wiek, tym wyższa zapadalność i niższy wskaźnik przeżycia. Rak tarczycy występuje trzy razy częściej u kobiet niż u mężczyzn, a wskaźnik ten jest mniej więcej stały na całym świecie. Zmienność genetyczna w linii zarodkowej u 25% pacjentów z rakiem rdzeniastym tarczycy jest związana z dziedzicznymi zespołami mnogich guzów endokrynnych typu 2A i 2B. Dziedziczność występuje u 3% do 9% pacjentów z dobrze zróżnicowanym rakiem tarczycy.
Obserwacja ponad 8 milionów mieszkańców Danii wykazała, że nietoksyczne wole guzkowe wiąże się ze zwiększonym ryzykiem raka tarczycy. W retrospektywnym badaniu kohortowym 843 pacjentów poddanych operacji tarczycy z powodu jednostronnego lub obustronnego guzka tarczycy, wola lub autoimmunologicznej choroby tarczycy, wyższe przedoperacyjne stężenie tyreotropiny (TSH) w surowicy wiązało się z rakiem tarczycy: u 16% pacjentów z poziomem TSH poniżej 0,06 mIU/l rozwinął się rak tarczycy, podczas gdy u 52% pacjentów z TSH ≥5 mIU/l rozwinął się rak tarczycy.
Osoby z rakiem tarczycy często nie mają żadnych objawów. Retrospektywne badanie 1328 pacjentów z rakiem tarczycy w 16 ośrodkach w 4 krajach wykazało, że tylko 30% (183/613) miało objawy w momencie rozpoznania. Pacjenci z guzem w szyi, dysfagią, uczuciem ciała obcego i chrypką są zazwyczaj w cięższym stanie.
Rak tarczycy tradycyjnie objawia się wyczuwalnym guzkiem tarczycy. Częstość występowania raka tarczycy w wyczuwalnych guzkach wynosi około 5% i 1% odpowiednio u kobiet i mężczyzn w regionach świata, w których występuje odpowiednia podaż jodu. Obecnie około 30% do 40% przypadków raka tarczycy jest wykrywanych palpacyjnie. Inne powszechne metody diagnostyczne obejmują badania obrazowe niezwiązane z tarczycą (np. USG tętnic szyjnych, szyi, kręgosłupa i klatki piersiowej); pacjenci z nadczynnością lub niedoczynnością tarczycy, którzy nie dotykali guzków, otrzymują USG tarczycy; pacjenci z istniejącymi guzkami tarczycy byli poddawani powtórnemu badaniu USG; podczas pooperacyjnego badania patologicznego nieoczekiwanie odkryto utajonego raka tarczycy.
Ultrasonografia jest preferowaną metodą oceny wyczuwalnych guzków tarczycy lub innych zmian obrazowych guzków tarczycy. Ultrasonografia jest niezwykle czuła w określaniu liczby i charakterystyki guzków tarczycy, a także cech wysokiego ryzyka związanych z ryzykiem złośliwości, takich jak nieregularności brzeżne, punktowe ogniska o silnym echu oraz naciekanie poza tarczycę.
Obecnie naddiagnostyka i leczenie raka tarczycy stanowi problem, na który wielu lekarzy i pacjentów zwraca szczególną uwagę, a klinicyści powinni starać się go unikać. Osiągnięcie tej równowagi jest jednak trudne, ponieważ nie wszyscy pacjenci z zaawansowanym, przerzutowym rakiem tarczycy mogą wyczuć guzki tarczycy, a nie wszystkie rozpoznania raka tarczycy o niskim ryzyku są możliwe do uniknięcia. Na przykład, sporadyczny mikrorak tarczycy, który może nigdy nie powodować objawów ani śmierci, może zostać zdiagnozowany histologicznie po operacji łagodnej choroby tarczycy.
Minimalnie inwazyjne terapie interwencyjne, takie jak ablacja radiofrekwencją pod kontrolą USG, ablacja mikrofalowa i ablacja laserowa, stanowią obiecującą alternatywę dla leczenia chirurgicznego w przypadku raka tarczycy o niskim ryzyku wymagającym leczenia. Chociaż mechanizmy działania tych trzech metod ablacji różnią się nieznacznie, są one zasadniczo podobne pod względem kryteriów selekcji guza, odpowiedzi na leczenie i powikłań pooperacyjnych. Obecnie większość lekarzy zgadza się, że idealną cechą guza do minimalnie inwazyjnej interwencji jest wewnętrzny rak brodawkowaty tarczycy o średnicy <10 mm i >5 mm od struktur wrażliwych na ciepło, takich jak tchawica, przełyk i nerw krtaniowy wsteczny. Najczęstszym powikłaniem po leczeniu pozostaje niezamierzone uszkodzenie cieplne pobliskiego nerwu krtaniowego wstecznego, powodujące przejściową chrypkę. Aby zminimalizować uszkodzenie otaczających struktur, zaleca się zachowanie bezpiecznej odległości od zmiany docelowej.
Wiele badań wykazało, że małoinwazyjne interwencje w leczeniu mikroraków brodawkowatych tarczycy charakteryzują się dobrą skutecznością i bezpieczeństwem. Chociaż małoinwazyjne interwencje w leczeniu raka brodawkowatego tarczycy o niskim ryzyku przyniosły obiecujące wyniki, większość badań miała charakter retrospektywny i koncentrowała się na Chinach, Włoszech i Korei Południowej. Ponadto nie przeprowadzono bezpośredniego porównania między zastosowaniem małoinwazyjnych interwencji a aktywnym nadzorem. Dlatego też termoablacja pod kontrolą USG jest odpowiednia jedynie dla pacjentów z rakiem tarczycy o niskim ryzyku, którzy nie kwalifikują się do leczenia operacyjnego lub preferują tę opcję leczenia.
W przyszłości, u pacjentów z klinicznie istotnym rakiem tarczycy, minimalnie inwazyjna terapia interwencyjna może stanowić kolejną opcję leczenia obarczoną mniejszym ryzykiem powikłań niż leczenie chirurgiczne. Od 2021 roku techniki ablacji termicznej są stosowane w leczeniu pacjentów z rakiem tarczycy poniżej 38 mm (T1b–T2) z cechami wysokiego ryzyka. Jednakże, te retrospektywne badania obejmowały niewielką kohortę pacjentów (od 12 do 172) i krótki okres obserwacji (średnio 19,8–25,0 miesięcy). Dlatego potrzebne są dalsze badania, aby zrozumieć wartość ablacji termicznej w leczeniu pacjentów z klinicznie istotnym rakiem tarczycy.
Leczenie chirurgiczne pozostaje podstawową metodą leczenia w przypadku podejrzenia lub cytologicznie potwierdzonego zróżnicowanego raka tarczycy. Istnieją kontrowersje dotyczące najodpowiedniejszego zakresu tyreoidektomii (lobektomia i całkowita tyreoidektomia). Pacjenci poddawani całkowitej tyreoidektomii są narażeni na większe ryzyko chirurgiczne niż pacjenci poddawani lobektomii. Ryzyko związane z operacją tarczycy obejmuje uszkodzenie nerwu krtaniowego wstecznego, niedoczynność przytarczyc, powikłania gojenia się rany oraz konieczność suplementacji hormonów tarczycy. W przeszłości całkowita tyreoidektomia była preferowaną metodą leczenia wszystkich zróżnicowanych raków tarczycy > 10 mm. Jednak badanie Adama i wsp. z 2014 roku wykazało brak statystycznie istotnej różnicy w przeżyciu i ryzyku nawrotu między pacjentami poddanymi lobektomii a całkowitą tyreoidektomią w przypadku raka brodawkowatego tarczycy o średnicy od 10 mm do 40 mm bez cech klinicznie wysokiego ryzyka.
Dlatego obecnie lobektomia jest zazwyczaj preferowana w przypadku jednostronnego, dobrze zróżnicowanego raka tarczycy < 40 mm. Całkowita tyreoidektomia jest generalnie zalecana w przypadku dobrze zróżnicowanego raka tarczycy o średnicy 40 mm lub większej oraz obustronnego raka tarczycy. Jeśli guz rozprzestrzenił się do regionalnych węzłów chłonnych, należy wykonać limfadenektomię centralnych i bocznych węzłów chłonnych szyi. Profilaktyczna limfadenektomia centralnych węzłów chłonnych jest konieczna tylko u pacjentów z rdzeniastym rakiem tarczycy i niektórymi wysoko zróżnicowanymi rakami tarczycy o dużej objętości, a także u pacjentów z zewnętrzną agresją tarczycy. Profilaktyczna limfadenektomia bocznych węzłów chłonnych szyi może być rozważona u pacjentów z rdzeniastym rakiem tarczycy. U pacjentów z podejrzeniem dziedzicznego raka rdzeniastego tarczycy, przed operacją należy ocenić stężenie noradrenaliny, wapnia i parathormonu (PTH) w osoczu w celu identyfikacji zespołu MEN2A i uniknięcia przeoczenia guza chromochłonnego nadnerczy i nadczynności przytarczyc.
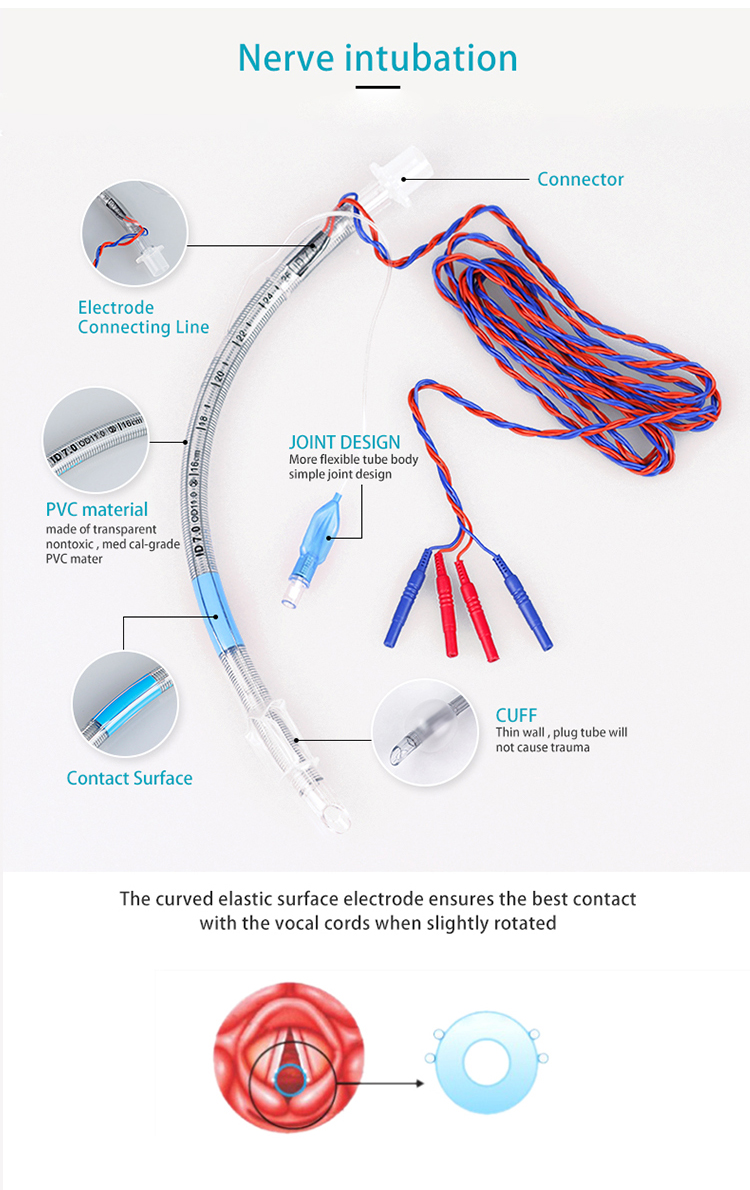
Intubację nerwów stosuje się głównie w celu podłączenia do odpowiedniego monitora nerwów w celu zapewnienia dyskretnej drogi oddechowej oraz monitorowania śródoperacyjnej aktywności mięśni i nerwów w krtani.
Rurka intubacyjna EMG - kliknij tutaj
Czas publikacji: 16 marca 2024 r.