Szpitalne zapalenie płuc jest najczęstszą i najpoważniejszą infekcją szpitalną, a 40% przypadków stanowi zapalenie płuc związane z wentylacją mechaniczną (VAP). VAP wywołane przez oporne patogeny nadal stanowi trudny problem kliniczny. Od lat wytyczne zalecają szereg interwencji (takich jak sedacja celowana, uniesienie głowy) w celu zapobiegania VAP, jednak VAP występuje u nawet 40% pacjentów z intubacją dotchawiczą, co skutkuje dłuższym pobytem w szpitalu, zwiększonym zapotrzebowaniem na antybiotyki i zgonem. Ludzie stale poszukują skuteczniejszych metod zapobiegania.
Zapalenie płuc związane z wentylacją mechaniczną (VAP) to nowy rodzaj zapalenia płuc, który rozwija się 48 godzin po intubacji dotchawiczej i jest najczęstszą i najgroźniejszą infekcją szpitalną na oddziale intensywnej terapii (OIT). Wytyczne Amerykańskiego Towarzystwa Chorób Zakaźnych z 2016 roku odróżniają VAP od definicji szpitalnego zapalenia płuc (HAP) (HAP odnosi się wyłącznie do zapalenia płuc występującego po hospitalizacji bez rurki intubacyjnej i niezwiązanego z wentylacją mechaniczną; VAP to zapalenie płuc po intubacji dotchawiczej i wentylacji mechanicznej), a Europejskie Towarzystwo Chorób Zakaźnych i Chiny uważają, że VAP nadal stanowi szczególny rodzaj HAP [1–3].
U pacjentów poddawanych wentylacji mechanicznej częstość występowania VAP waha się od 9% do 27%, śmiertelność szacuje się na 13%, a może to prowadzić do zwiększonego stosowania antybiotyków systemowych, przedłużonej wentylacji mechanicznej, przedłużonego pobytu na oddziale intensywnej terapii i zwiększonych kosztów [4-6]. HAP/VAP u pacjentów bez niedoborów odporności jest zwykle spowodowane infekcją bakteryjną, a dystrybucja powszechnych patogenów i ich charakterystyka oporności różnią się w zależności od regionu, klasy szpitala, populacji pacjentów i ekspozycji na antybiotyki oraz zmieniają się w czasie. Pseudomonas aeruginosa dominowała wśród patogenów związanych z VAP w Europie i Ameryce, podczas gdy więcej Acinetobacter baumannii wyizolowano w szpitalach trzeciego stopnia w Chinach. Jedna trzecia do połowy wszystkich zgonów związanych z VAP jest bezpośrednio spowodowana infekcją, przy czym śmiertelność przypadków spowodowanych przez Pseudomonas aeruginosa i acinetobacter jest wyższa [7,8].
Ze względu na silną heterogeniczność VAP, swoistość diagnostyczna jego objawów klinicznych, badań obrazowych i laboratoryjnych jest niska, a zakres diagnostyki różnicowej jest szeroki, co utrudnia terminowe rozpoznanie VAP. Jednocześnie oporność bakterii stanowi poważne wyzwanie dla leczenia VAP. Szacuje się, że ryzyko rozwoju VAP wynosi 3%/dzień w ciągu pierwszych 5 dni stosowania wentylacji mechanicznej, 2%/dzień między 5 a 10 dniem i 1%/dzień przez pozostały czas. Szczyt zapadalności występuje zazwyczaj po 7 dniach wentylacji, więc istnieje okno, w którym można zapobiec zakażeniu na wczesnym etapie [9,10]. Wiele badań dotyczyło zapobiegania VAP, ale pomimo dziesięcioleci badań i prób zapobiegania VAP (takich jak unikanie intubacji, zapobieganie ponownej intubacji, zmniejszanie sedacji, unoszenie wezgłowia łóżka o 30° do 45° i pielęgnacja jamy ustnej), zapadalność nie wydaje się zmniejszać, a związane z nią obciążenie medyczne pozostaje bardzo wysokie.
Wziewne antybiotyki są stosowane w leczeniu przewlekłych infekcji dróg oddechowych od lat 40. XX wieku. Ponieważ mogą one zmaksymalizować dostarczanie leków do miejsca docelowego infekcji (tj. dróg oddechowych) i zmniejszyć ogólnoustrojowe działania niepożądane, wykazały dobrą wartość zastosowania w wielu chorobach. Wziewne antybiotyki są obecnie zatwierdzone przez amerykańską Agencję ds. Żywności i Leków (FDA) oraz Europejską Agencję Leków (EMA) do stosowania w mukowiscydozie. Wziewne antybiotyki mogą znacząco zmniejszyć ładunek bakteryjny i częstość zaostrzeń w rozstrzeniach oskrzeli bez zwiększania ogólnej liczby zdarzeń niepożądanych, a obecne wytyczne uznają je za leczenie pierwszego rzutu u pacjentów z zakażeniem Pseudomonas aeruginosa i częstymi zaostrzeniami; Wziewne antybiotyki w okresie okołooperacyjnym przeszczepu płuca mogą być również stosowane jako leki adiuwantowe lub profilaktyczne [11,12]. Jednak w wytycznych US VAP z 2016 r. eksperci nie mieli pewności co do skuteczności adiuwantowych wziewnych antybiotyków ze względu na brak dużych randomizowanych badań kontrolowanych. Badanie fazy 3 (INHALE) opublikowane w 2020 r. również nie dało pozytywnych wyników (inhalacja amikacyny wspomagana dożylnymi antybiotykami w przypadku zakażeń bakteriami Gram-ujemnymi wywołanych przez pacjentów z VAP, podwójnie ślepe, randomizowane, kontrolowane placebo badanie skuteczności fazy 3, łącznie 807 pacjentów, leczenie ogólnoustrojowe + wspomagana inhalacja amikacyny przez 10 dni).
W tym kontekście zespół kierowany przez badaczy z Regionalnego Szpitala Uniwersyteckiego w Tours (CHRU) we Francji przyjął inną strategię badawczą i przeprowadził zainicjowane przez badaczy, wieloośrodkowe, podwójnie zaślepione, randomizowane badanie skuteczności (AMIKINHAL). W 19 przypadkach we Francji porównano skuteczność wziewnej amikacyny lub placebo w profilaktyce VAP [13].
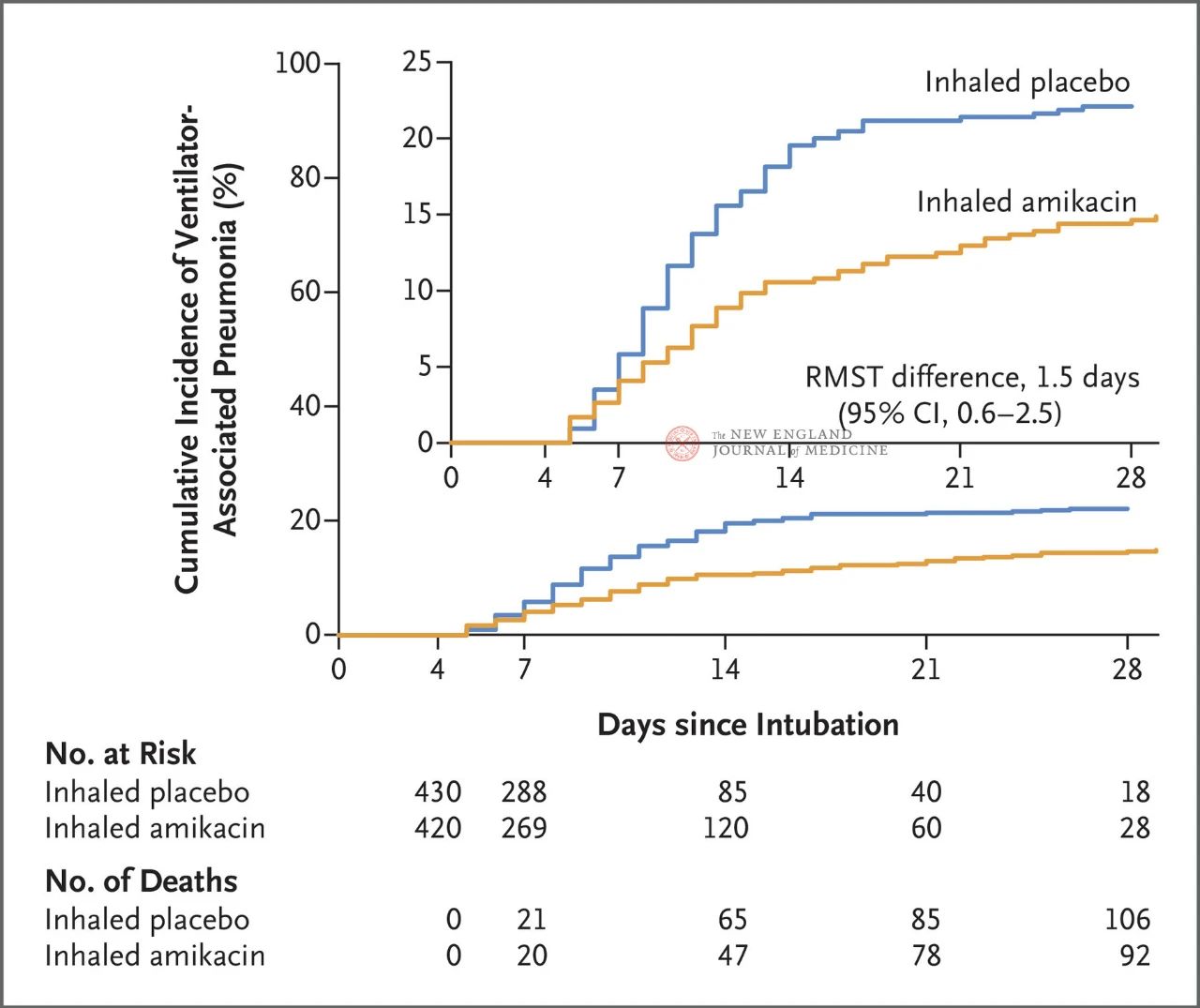
Łącznie 847 dorosłych pacjentów z inwazyjną wentylacją mechaniczną w okresie od 72 do 96 godzin zostało losowo przydzielonych w stosunku 1:1 do inhalacji amikacyny (N= 417, 20 mg/kg masy ciała, QD) lub inhalacji placebo (N=430, ekwiwalent 0,9% chlorku sodu) przez 3 dni. Pierwszorzędowym punktem końcowym był pierwszy epizod VAP od początku randomizowanego przydziału do 28. dnia.
Wyniki badania wykazały, że po 28 dniach u 62 pacjentów (15%) z grupy otrzymującej amikacynę wystąpiło VAP, a u 95 pacjentów (22%) z grupy placebo (ograniczona różnica w średnim przeżyciu w przypadku VAP wyniosła 1,5 dnia; 95% CI, 0,6~2,5; P=0,004).
Pod względem bezpieczeństwa, u siedmiu pacjentów (1,7%) w grupie amikacyny i czterech pacjentów (0,9%) w grupie placebo wystąpiły poważne zdarzenia niepożądane związane z badaniem. Spośród osób, u których w momencie randomizacji nie stwierdzono ostrego uszkodzenia nerek, u 11 pacjentów (4%) w grupie amikacyny i 24 pacjentów (8%) w grupie placebo wystąpiło ostre uszkodzenie nerek w 28. dniu badania (HR: 0,47; 95% CI: 0,23~0,96).
Badanie kliniczne miało trzy główne punkty. Po pierwsze, pod względem projektu badawczego, badanie AMIKINHAL opiera się na badaniu IASIS (randomizowanym, podwójnie zaślepionym, kontrolowanym placebo, równoległym badaniu fazy 2 z udziałem 143 pacjentów). Aby ocenić bezpieczeństwo i skuteczność inhalacji amikacyną i fosfomycyną w ogólnoustrojowym leczeniu zakażeń bakteriami Gram-ujemnymi wywołanych przez VAP) oraz badaniu INHALE, które zakończyło się negatywnymi wynikami, skupionymi na zapobieganiu VAP, i uzyskało stosunkowo dobre wyniki. Ze względu na wysoką śmiertelność i długi pobyt w szpitalu u pacjentów z wentylacją mechaniczną i VAP, jeśli inhalacja amikacyną może osiągnąć znacząco różne wyniki w zakresie redukcji śmiertelności i hospitalizacji u tych pacjentów, będzie ona bardziej wartościowa dla praktyki klinicznej. Jednakże, biorąc pod uwagę heterogeniczność późnego leczenia i opieki u każdego pacjenta i w każdym ośrodku, istnieje szereg czynników zakłócających, które mogą zakłócać badanie, dlatego uzyskanie pozytywnego wyniku przypisanego antybiotykom wziewnym może być również trudne. Dlatego też, aby badanie kliniczne zakończyło się sukcesem, konieczny jest nie tylko doskonały projekt badania, ale także dobór odpowiednich głównych punktów końcowych.
Po drugie, chociaż antybiotyki aminoglikozydowe nie są zalecane jako pojedynczy lek w różnych wytycznych dotyczących VAP, mogą one obejmować powszechne patogeny u pacjentów z VAP (w tym Pseudomonas aeruginosa, Acinetobacter itp.), a ze względu na ich ograniczone wchłanianie przez komórki nabłonka płuc, wysokie stężenie w miejscu zakażenia i niską toksyczność ogólnoustrojową. Antybiotyki aminoglikozydowe są powszechnie preferowane wśród antybiotyków wziewnych. Niniejsza praca jest zgodna z kompleksową oceną wielkości efektu dotchawiczego podania gentamycyny w małych próbkach, opublikowaną wcześniej, która łącznie wykazuje wpływ wziewnych antybiotyków aminoglikozydowych w zapobieganiu VAP. Należy również zauważyć, że większość kontroli placebo wybranych w badaniach dotyczących antybiotyków wziewnych to sól fizjologiczna. Biorąc jednak pod uwagę, że sama inhalacja rozpylona solą fizjologiczną może odgrywać pewną rolę w rozcieńczaniu plwociny i wspomaganiu działania wykrztuśnego, sól fizjologiczna może powodować pewne zakłócenia w analizie wyników badania, co powinno zostać kompleksowo uwzględnione w badaniu.
Co więcej, lokalna adaptacja leków na HAP/VAP jest istotna, podobnie jak profilaktyka antybiotykowa. Jednocześnie, niezależnie od czasu intubacji, ekologia lokalnego OIOM-u jest najważniejszym czynnikiem ryzyka zakażenia bakteriami wielolekoopornymi. Dlatego leczenie empiryczne powinno w jak największym stopniu opierać się na danych mikrobiologicznych lokalnych szpitali, a nie na wytycznych lub doświadczeniu szpitali trzeciego stopnia referencyjności. Jednocześnie u pacjentów w stanie krytycznym, wymagających wentylacji mechanicznej, często współwystępują choroby wielonarządowe, a pod wpływem łącznego działania wielu czynników, takich jak stan stresu, może również wystąpić zjawisko przenikania drobnoustrojów jelitowych do płuc. Wysoka heterogeniczność chorób spowodowana nałożeniem się czynników wewnętrznych i zewnętrznych również sprawia, że masowa promocja kliniczna każdej nowej interwencji jest jeszcze daleka od realizacji.
Czas publikacji: 02-12-2023